Mesterséges metalloproteinek projekt
Szervetlen és Analitikai Kémia Tanszék
Bioszervetlen Kémia Kutatócsoport
Mesterséges metallonukleázok tervezése és vizsgálata
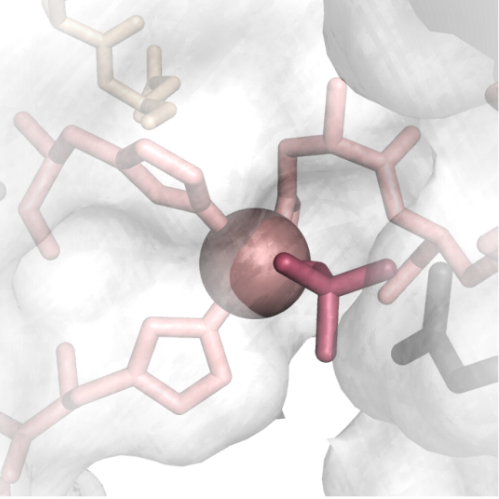 A Duchenne-féle izomdisztrófia ún. monogenetikus betegség, azaz egyetlen gén hibája okozza. Az ilyen génhibákat szervezet javítómechanizmusa nem ismeri fel, azonban a DNS adott helyen történő hasításával a hiba „láthatóvá” tehető és megfelelő DNS-minta jelenlétében javítható. A DNS tetszőleges helyen történő specifikus hasítására mesterséges nukleázokat (hasító enzimeket) terveznek, azonban ezek eddig citotoxikusnak mutatkoztak. Kutatócsoportunk célja egy új, biztonságos mesterséges metallonukleáz tervezése, amihez a colicin E7 fehérje nukleáz doménjét szeretnénk használni. Ebben a fehérjében ugyanis az aktív központhoz közel kerül a szekvencia egy távolabbi része, amely nélkül a nukleáz nem aktív. Ez egy allosztérikus szabályozásra adhat alapot, amiről azonban ezidáig kevés információ áll rendelkezésre. Ehhez kapcsolódóan a következő témákkal foglalkozunk: -Allosztérikus szabályozás tanulmányozása a colicin E7 fehérje nukleáz doménjében: a fehérjében mutációkat hozunk létre és vizsgáljuk az ezáltal bekövetkező nukleáz aktivitás csökkenését, DNS-kötés változását, fémionkötés módját. -Colicin E7 nukleáz domén hozzáfűzése cinkujjakhoz: célunk egy specifikus mesterséges nukleáz létrehozása. A colicin E7 nemspecifikus nukleáz doménje úgy tehető specifikussá, hogy hozzáfűzzük pl. cinkujj-fehérjékhez, amelyek a tervezésnek megfelelően csak az adott helyen kötődnek a DNS-hez. Az így kialakított nukleázokban a cinkujjak biztosítják a specifikus szubsztrát-kötődést, a colicin E7 nukleáz doménje pedig hasítja a DNS-t.
A Duchenne-féle izomdisztrófia ún. monogenetikus betegség, azaz egyetlen gén hibája okozza. Az ilyen génhibákat szervezet javítómechanizmusa nem ismeri fel, azonban a DNS adott helyen történő hasításával a hiba „láthatóvá” tehető és megfelelő DNS-minta jelenlétében javítható. A DNS tetszőleges helyen történő specifikus hasítására mesterséges nukleázokat (hasító enzimeket) terveznek, azonban ezek eddig citotoxikusnak mutatkoztak. Kutatócsoportunk célja egy új, biztonságos mesterséges metallonukleáz tervezése, amihez a colicin E7 fehérje nukleáz doménjét szeretnénk használni. Ebben a fehérjében ugyanis az aktív központhoz közel kerül a szekvencia egy távolabbi része, amely nélkül a nukleáz nem aktív. Ez egy allosztérikus szabályozásra adhat alapot, amiről azonban ezidáig kevés információ áll rendelkezésre. Ehhez kapcsolódóan a következő témákkal foglalkozunk: -Allosztérikus szabályozás tanulmányozása a colicin E7 fehérje nukleáz doménjében: a fehérjében mutációkat hozunk létre és vizsgáljuk az ezáltal bekövetkező nukleáz aktivitás csökkenését, DNS-kötés változását, fémionkötés módját. -Colicin E7 nukleáz domén hozzáfűzése cinkujjakhoz: célunk egy specifikus mesterséges nukleáz létrehozása. A colicin E7 nemspecifikus nukleáz doménje úgy tehető specifikussá, hogy hozzáfűzzük pl. cinkujj-fehérjékhez, amelyek a tervezésnek megfelelően csak az adott helyen kötődnek a DNS-hez. Az így kialakított nukleázokban a cinkujjak biztosítják a specifikus szubsztrát-kötődést, a colicin E7 nukleáz doménje pedig hasítja a DNS-t.
Fémionszabályzó fehérjék
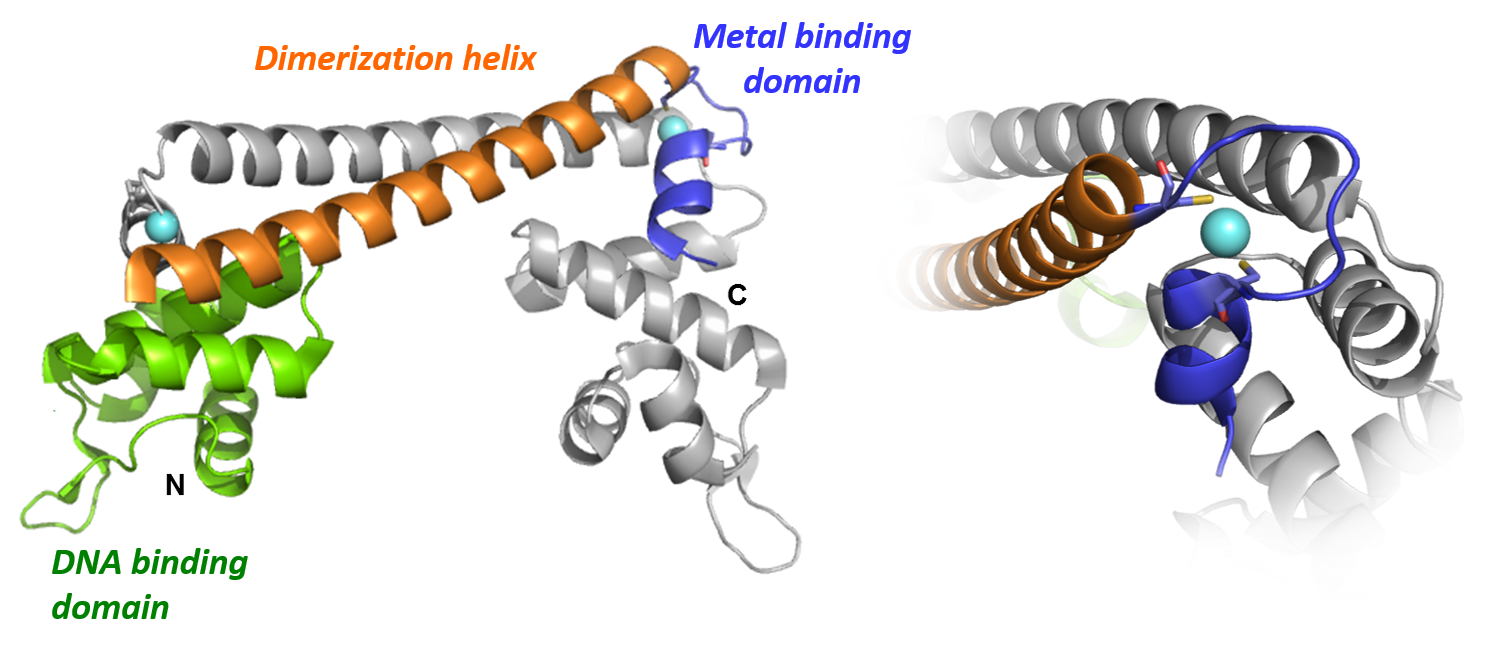 Számos fémion, köztük átmenetifémionok is, jelentős szerepet játszanak biokémiai folyamatok lejátszódásában. Ugyanakkor több fémion egyértelműen toxikus hatású az élő szervezetek számára. Az esszenciális fémionok is káros folyamatokat idéznek elő, amennyiben koncentrációjuk meghaladja az adott szervezet számára optimális koncentráció-tartományt. A fémionok koncentrációjának szabályozása, illetve a toxikus fémionokkal szembeni védekező mechanizmusok működtetése alapvető fontosságú minden organizmusban. A fémionok homeosztatikus egyensúlyát különböző szállítási, átalakítási, raktározási és szabályzó folyamatok összessége biztosítja. A bakteriális fémion-homeosztázisban kulcsfontosságú szerepet töltenek be olyan fémion-érzékeny, a transzkripció szintjén működő szabályzó fehérjék, melyek az adott ion koncentrációjának megváltozására úgy reagálnak, hogy az annak szintjét befolyásoló fehérjék képződését indukálják vagy gátolják. Kutatásaink elsősorban a MerR és ArsR fehérjecsaládokba tartozó fehérjékre fokuszálnak, melyek közül is elsősorban a réz-effluxot szabályozó CueR fehérje fémion-szelektív működésének jobb megismerésére koncentrálunk. A vizsgálatok során a fehérjék fémion-kötőhelyein alapuló modellpeptidek, illetve a természetes fehérjék és tervezett mutánsaik különböző fémionokkal történő kölcsönhatását tanulmányozzuk. A vizsgált fehérjék speciális szabályzó-érzékelő mechanizmusa kihasználható arra is, hogy olyan genetikailag módosított baktériumokat tervezzünk, melyek egy adott fémion jelenlétében fluoreszcens fehérjét (is) termelnek, ezzel jelezve a fémion jelenlétét, ill. koncentrációjának megváltozását.
Számos fémion, köztük átmenetifémionok is, jelentős szerepet játszanak biokémiai folyamatok lejátszódásában. Ugyanakkor több fémion egyértelműen toxikus hatású az élő szervezetek számára. Az esszenciális fémionok is káros folyamatokat idéznek elő, amennyiben koncentrációjuk meghaladja az adott szervezet számára optimális koncentráció-tartományt. A fémionok koncentrációjának szabályozása, illetve a toxikus fémionokkal szembeni védekező mechanizmusok működtetése alapvető fontosságú minden organizmusban. A fémionok homeosztatikus egyensúlyát különböző szállítási, átalakítási, raktározási és szabályzó folyamatok összessége biztosítja. A bakteriális fémion-homeosztázisban kulcsfontosságú szerepet töltenek be olyan fémion-érzékeny, a transzkripció szintjén működő szabályzó fehérjék, melyek az adott ion koncentrációjának megváltozására úgy reagálnak, hogy az annak szintjét befolyásoló fehérjék képződését indukálják vagy gátolják. Kutatásaink elsősorban a MerR és ArsR fehérjecsaládokba tartozó fehérjékre fokuszálnak, melyek közül is elsősorban a réz-effluxot szabályozó CueR fehérje fémion-szelektív működésének jobb megismerésére koncentrálunk. A vizsgálatok során a fehérjék fémion-kötőhelyein alapuló modellpeptidek, illetve a természetes fehérjék és tervezett mutánsaik különböző fémionokkal történő kölcsönhatását tanulmányozzuk. A vizsgált fehérjék speciális szabályzó-érzékelő mechanizmusa kihasználható arra is, hogy olyan genetikailag módosított baktériumokat tervezzünk, melyek egy adott fémion jelenlétében fluoreszcens fehérjét (is) termelnek, ezzel jelezve a fémion jelenlétét, ill. koncentrációjának megváltozását.
AsIII (és SbIII) kölcsönhatása tiol-ligandumokkal: biospeciáció, biokémiai hatás, kelátor fejlesztés
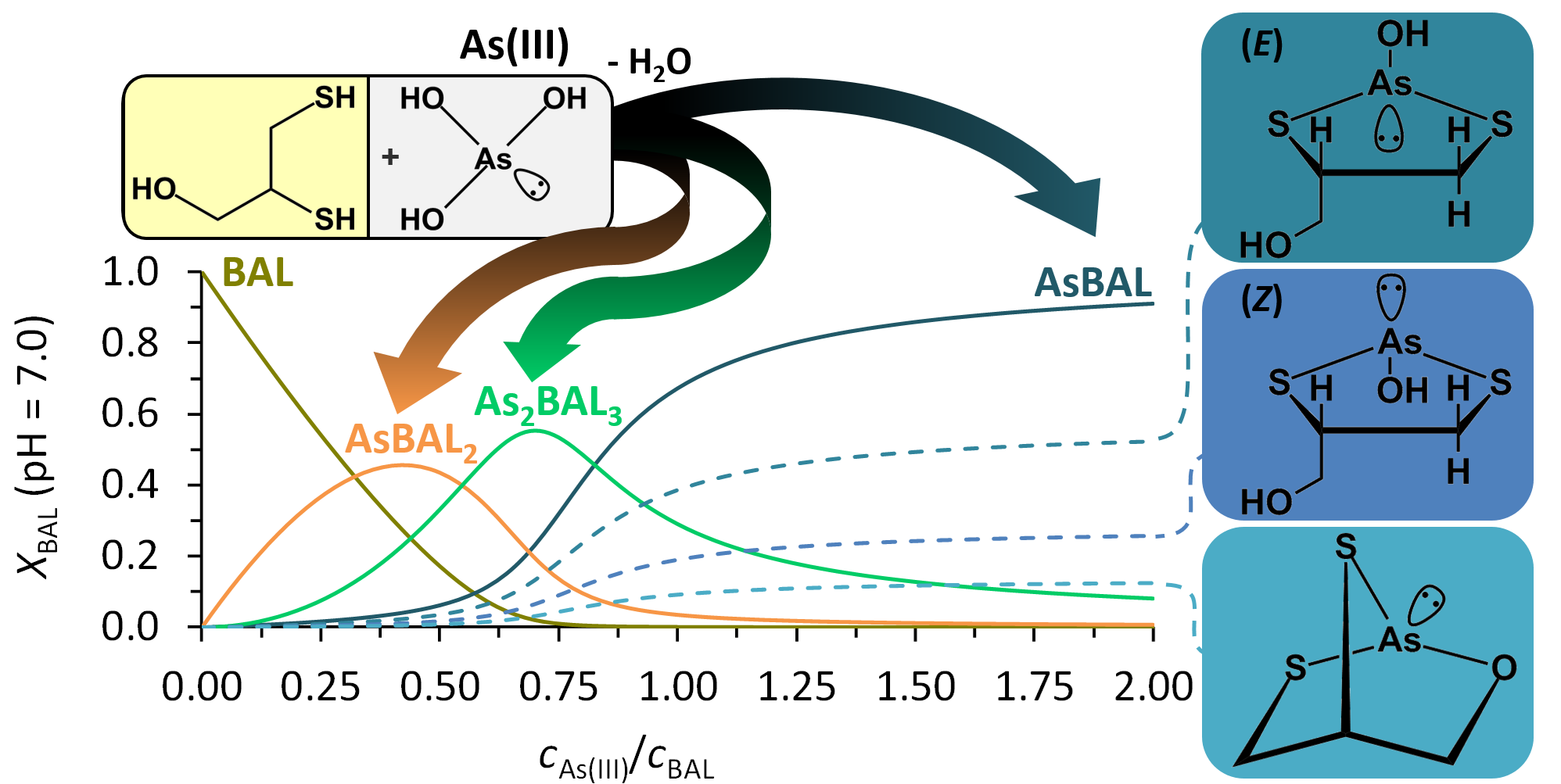 Az arzén különböző megjelenési formáinak sejtekre és szövetekre gyakorolt káros hatásai közismertek. Ezek éles kontrasztjaként az arzén vegyületeit évezredek óta használják különböző betegségek, elváltozások pl. a pestis, malária vagy fekélyek, kezelésére. Ezen vegyületek közül a legfontosabb az arzén-trioxid (As2O3), melynek jelentős antitumor hatását mutatták ki a human akut promileucitás leukémiával szemben. A feltételezések szerint a terápiás és toxikus hatások kialakulásában hasonló mechanizmusok játszhatnak szerepet, azonban ezek molekuláris részleteit még nem tárták fel. Az arzén +3-as oxidációs állapotában kapcsolódni képes tiol ligandumok redukált formáihoz, különösen, ha több ilyen csoport áll rendelkezésre, és ez a kölcsönhatás az arzén több fiziológiás hatásában szerepet játszik. Meglepő módon az AsIII és tiolcsoportokat tartalmazó kismolekulák oldatbeli speciációs viszonyait alig tanulmányozták, annak ellenére, hogy az AsIII-tiol kölcsönhatás modellezése alapvető jelentőségű lehet az arzén változatos, gyakran paradox biológiai hatásainak megértéséhez. Kutatásaink célja, hogy feltérképezzük az AsIII lehetséges és preferált koordinációs helyeit és koordinációs környezetét biológia rendszerekben. A cél eléréséhez az AsIII jellemző vizes oldatbeli formájának, az arzénessavnak (H3AsO3) különböző tiolcsoportokat tartalmazó modelligandumokkal, nehézfémion-kelátor molekulákkal illetve peptidekkel, történő kölcsönhatását tanulmányozzuk.
Az arzén különböző megjelenési formáinak sejtekre és szövetekre gyakorolt káros hatásai közismertek. Ezek éles kontrasztjaként az arzén vegyületeit évezredek óta használják különböző betegségek, elváltozások pl. a pestis, malária vagy fekélyek, kezelésére. Ezen vegyületek közül a legfontosabb az arzén-trioxid (As2O3), melynek jelentős antitumor hatását mutatták ki a human akut promileucitás leukémiával szemben. A feltételezések szerint a terápiás és toxikus hatások kialakulásában hasonló mechanizmusok játszhatnak szerepet, azonban ezek molekuláris részleteit még nem tárták fel. Az arzén +3-as oxidációs állapotában kapcsolódni képes tiol ligandumok redukált formáihoz, különösen, ha több ilyen csoport áll rendelkezésre, és ez a kölcsönhatás az arzén több fiziológiás hatásában szerepet játszik. Meglepő módon az AsIII és tiolcsoportokat tartalmazó kismolekulák oldatbeli speciációs viszonyait alig tanulmányozták, annak ellenére, hogy az AsIII-tiol kölcsönhatás modellezése alapvető jelentőségű lehet az arzén változatos, gyakran paradox biológiai hatásainak megértéséhez. Kutatásaink célja, hogy feltérképezzük az AsIII lehetséges és preferált koordinációs helyeit és koordinációs környezetét biológia rendszerekben. A cél eléréséhez az AsIII jellemző vizes oldatbeli formájának, az arzénessavnak (H3AsO3) különböző tiolcsoportokat tartalmazó modelligandumokkal, nehézfémion-kelátor molekulákkal illetve peptidekkel, történő kölcsönhatását tanulmányozzuk.
Peptidek, mint potenciális fémion-érzékelők
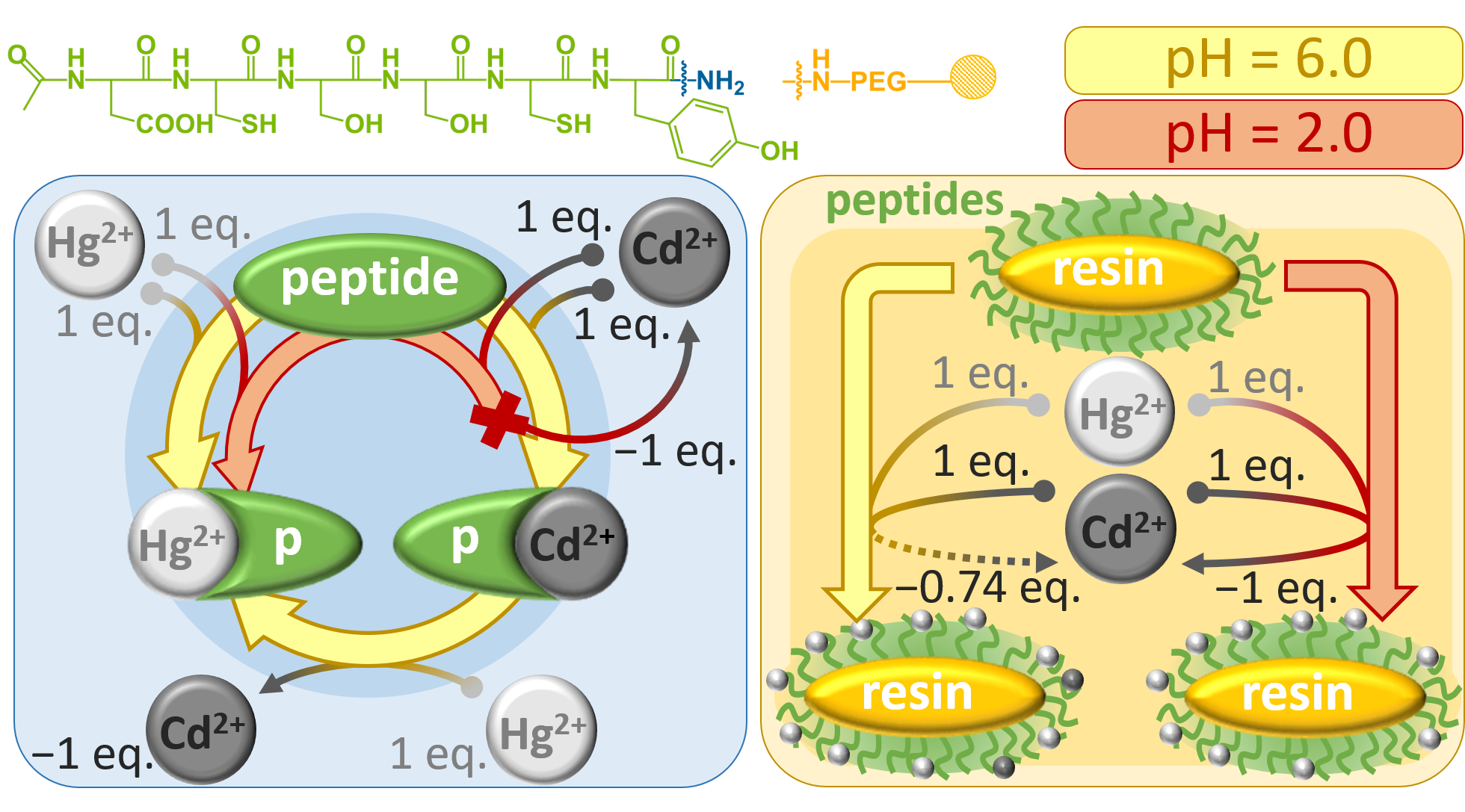 A környezetünkben megjelenő, természetes vagy mesterséges forrásokból származó nehézfémion szennyezők az élő szervezetek számára kockázatot jelentenek. A környezeti és (bio)analitikai kémiai kutatások egyik aktuális, népszerű témája olyan módszerek kidolgozása/fejlesztése, melyek a robusztus, nagyműszeres technikák alternatíváiként a fémion szennyezők érzékeny, gyors, egyszerű (akár helyszíni) kimutatását teszik lehetővé. Kutatásaink olyan, a toxikus fémionokat (illetve félfémeket) hatékonyan kötő oligopeptidek kifejlesztését és vizsgálatát célozzák, melyek potenciálisan fémion-receptorként működhetnek optokémiai szenzorokban. A vizsgált vegyületek szekvenciáit különböző metalloproteinek (dajka-, szállító- és fémszabályzó fehérjék) fémkötő helyei inspirálják. A molekulákba a fémion-megkötődés optikai érzékelését lehetővé tevő fluorofor csoportokat építünk be és törekszünk a vegyületek immobilizált (szilárd hordozókon, pl. gyanta, üveg, kvarc, rögzített) formában történő előállítására és vizsgálatára is.
A környezetünkben megjelenő, természetes vagy mesterséges forrásokból származó nehézfémion szennyezők az élő szervezetek számára kockázatot jelentenek. A környezeti és (bio)analitikai kémiai kutatások egyik aktuális, népszerű témája olyan módszerek kidolgozása/fejlesztése, melyek a robusztus, nagyműszeres technikák alternatíváiként a fémion szennyezők érzékeny, gyors, egyszerű (akár helyszíni) kimutatását teszik lehetővé. Kutatásaink olyan, a toxikus fémionokat (illetve félfémeket) hatékonyan kötő oligopeptidek kifejlesztését és vizsgálatát célozzák, melyek potenciálisan fémion-receptorként működhetnek optokémiai szenzorokban. A vizsgált vegyületek szekvenciáit különböző metalloproteinek (dajka-, szállító- és fémszabályzó fehérjék) fémkötő helyei inspirálják. A molekulákba a fémion-megkötődés optikai érzékelését lehetővé tevő fluorofor csoportokat építünk be és törekszünk a vegyületek immobilizált (szilárd hordozókon, pl. gyanta, üveg, kvarc, rögzített) formában történő előállítására és vizsgálatára is.
