A tömegspektrometria szerves és szervetlen vegyületek minőségi és mennyiségi elemzésére egyaránt használatos. Az elemek tömegspektrometriás vizsgálatát a 6.2 fejezetben tárgyaltuk, a 6.7 fejezetben pedig összefoglaltuk a kvantitatív tömegspektrometria elvét és alkalmazási lehetőségeit. Az alábbiakban a szerves vegyületek szerkezetvizsgálatában (minőségi analízisében) alkalmazott néhány további tömegspektrometriai módszert tekintünk át röviden.
Az egyes molekulák tömegének mérésén alapuló szerkezetvizsgálati módszer alapvető feltétele egy megfelelő ionizációs eljárás alkalmazása, amely során a vizsgálandó molekula energia betáplálása révén (pl. kinetikus, fény, elektromos, kémiai, stb. energia) fragmentálódik és ionizálódik, egyúttal gázfázisba is kerül. A különböző tömeg/töltés viszonyszámú molekula fragmens ionok gyakoriságát ábrázoló, a molekula minőségére (szerkezetére) nézve nagyon jellegzetes tömegspektrum felhasználásával meghatározható a molekula tömege, illetve szerkezete. A tömegspektrum összetettsége miatt - más szerkezetvizsgáló módszerekhez hasonlóan - a kvalitatív tömegspektrometriában is csak tiszta (szintetikus, vagy kapcsolt elválasztástechnikai eljárással tisztított) mintákat lehet vizsgálni.
A tömegspektrometriás módszerek általában egymáshoz nagyon hasonló műszerezettséget igényelnek, azonban az ionizációs eljárások (másképpen mintabeviteli eljárások) és a tömeganalizátor paramétereit tekintve az eszközökben és módszerekben jelentős különbségek állnak fenn, amely különbségek az egyes alkalmazásoknak megfelelő optimálás eredményei.
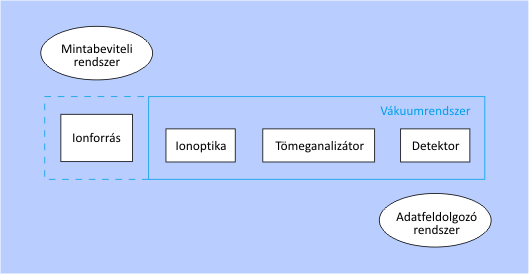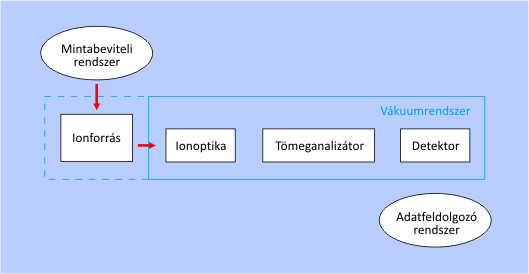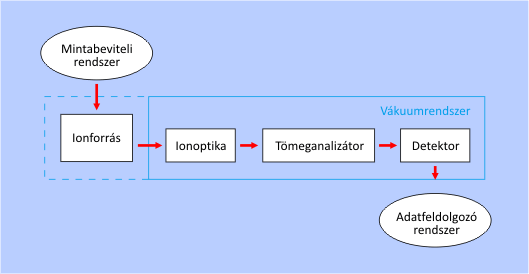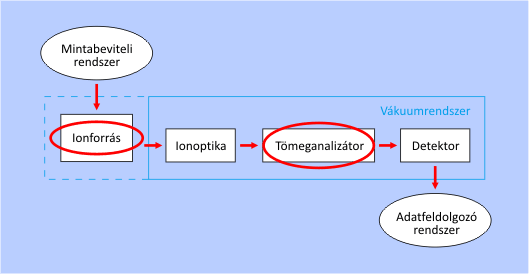
Egy tömegspektrométer felépítésének sémája
A szerkezetvizsgálat céljaira használt tömegspektrométerek ionizációs lehetőségei között elsősorban a vizsgálandó molekulák mérete és polaritása alapján szokás választani. A főbb lehetőségek a következők:
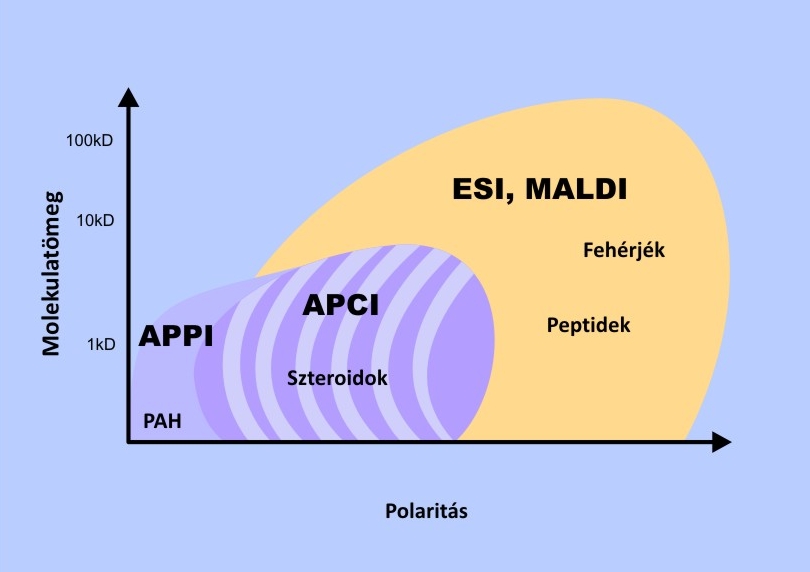
Ionizációs lehetőségek tipikus választási lehetőségei a tömegspektrometriában
Elektronütköztetéses ionizáció (electron impact ionization, EI)
Kémiai ionizáció (chemical ionization, CI)
Atmoszférikus nyomású kémiai ionizáció (atmospheric pressure chemical ionization, APCI)
Elektrospray ionizáció (electrospray ionization, ESI)
Mátrix-szal segített lézerdeszorpciós ionizáció (matrix-assisted laser absorption and ionization, MALDI)
Atmoszférikus nyomású fotoionizáció (atmospheric pressure photoionization, APPI).
Az első négy ionizációs eljárás működését röviden már ismertettük a jelen tananyag 3.1., 3.6. és 6.7. fejezeteiben. Az EI és CI a legelterjedtebb, ma rutinszerűen a legtöbb MS műszerben elérhető ionizációs eljárás. Az APPI ionizációs eljárás a legújabb, amelyet kimondottan a folyadékminták kevéssé poláros komponenseinek analízisére fejlesztettek ki. Az ionizációt ebben az eszközben egy Kr kisülési lámpa fénye végzi. Ezek a fotonok a kripton ionizációs energiájánál kisebb (kb. 10 eV) ionizációs energiájú vegyületeket hatékonyan ionizálják. Nem ionizálódik viszont a legtöbb gáz és oldószer, ami az MS spektrum háttérszintjét a spektrális zavaró határokat csökkenti. További előny, hogy az ESI és APCI módszerekkel szemben, amelyeknél az ionizáció hatékonysága a protonaffinitással arányos, az APPI esetében a meghatározó a mérendő molekula ionizációs energiája, vagyis kevéssé poláros molekulák is jól mérhetők.
A tömeganalizátorok szempontjából a legfontosabb újszerű lehetőséget a tandem tömegspektrometria (MS-MS) alkalmazása jelenti. Ezen műszerek egymás után kapcsolva két tömeganalizátort tartalmaznak. Az első feladata kiválasztani a számunkra fontos egyik iont az elsődleges fragmentációs mintázatból (spektrumból), amelynek tömegspektrumát újbóli ionizációt (fragmentációt) követően a második tömeganalizátor és a detektor veszi fel. A másodlagos ionizációt ilyenkor ún. ütközési cellával idézik elő. A tandem elrendezés nagymértékben segíti a tömegspektrum asszignációját és a kiválasztott fragmension szerkezetének meghatározását.
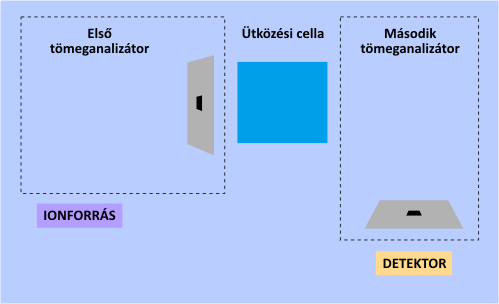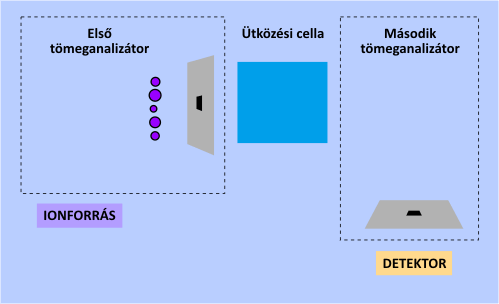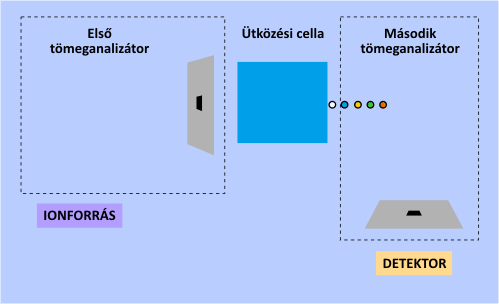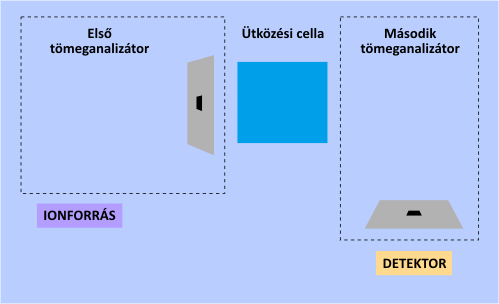
A tandem tömegspektrometria működési elve
A szerves vegyületek kvalitatív tömegspektrometriájában, mivel itt viszonylag kis tömegfelbontás elegendő a kiértékelhető spektrumok felvételére (hiszen a szerves vegyületek jellemezően csak néhány, kis rendszámú elem kombinációjaként állnak elő), ezért főként repülési idő és kvadrupólus rendszerű analizátorokat alkalmaznak.
Az ionizációs eljárás megválasztásával egy adott minta esetében döntően a tömegspektrometria két analitikai jellemzője befolyásolható: a fragmentációs mintázat összetettsége (ami mind a spektrális zavaró hatásokat, mind a csúcsok asszignációját befolyásolja) és az érzékenység (ami elsősorban a kvantitatív analízisben fontos). A fragmentáció esetére az alábbi spektrumok az EI és CI módszerek vonatkozásában mutatnak egy példát. A CI ionizációval kapott tömegspektrum általában egyszerűbb (az ionizáció kíméletesebb) és emiatt megjelenik a spektrumban a vizsgált molekula protonált formájának csúcsa (ez a legnagyobb tömegű csúcs), ami az azonosítást és molekulatömeg meghatározását nagymértékben megkönnyíti.
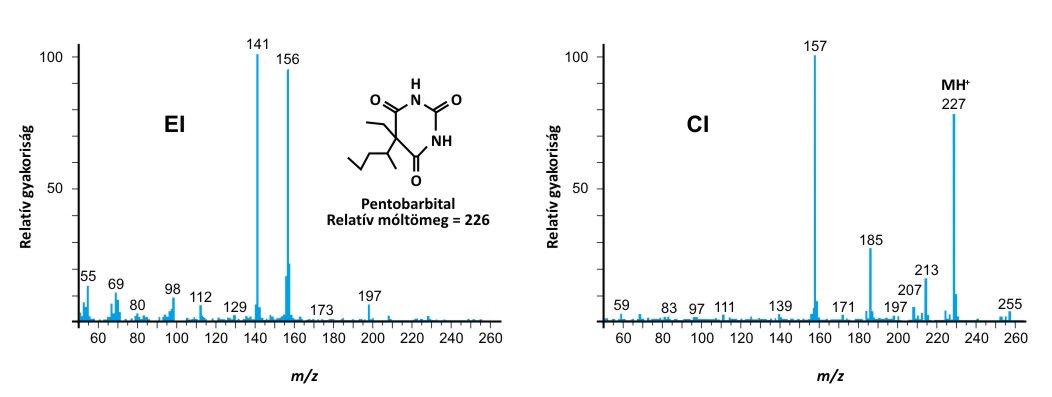
Az EI és CI ionizációs módszerekkel kapott tömegspektrumok közötti jellegzetes különbség (a pentobarbital példája)
Makromolekuláris minták (pl. polimerek, fehérjék, stb.) esetében különösen nagy fontosságú, hogy az ionizáció kíméletes legyen, mert ezeknél a fragmentáció egyébként igen nagymértékű lehet (a "lányionok" száma igen magas). Ezekre a molekulákra a legmegfelelőbb az ESI és MALDI ionizációs eljárás. A MALDI kimutatási határa is alacsony: 10-15-10-21 mol. A módszer előnye, hogy nagy molekulatömegű anyagok vizsgálatára alkalmas (400 Da -200 kDa), és keverékek közvetlen elemzésére is alkalmas. Hátránya, hogy közvetlenül nem kapcsolható össze elválasztástechnikai módszerekkel, mivel a vizsgálat előtt a mintát kristályosítani kell, valamint hogy mennyiségi meghatározásra nem alkalmas. Az ESI ionizációval kivitelezett tömegspektrometria az elválasztástechnikai módszerekhez könnyen kapcsolható, de a szervetlen sókat nem tolerálja. Az ESI-MS reprodukálhatósága jobb, mint a MALDI-MS módszeré.
A tömegspektrumok értelmezése, a spektrumcsúcsok assszignációja összességében nem egyszerű. Egy további, említésre érdemes komplikációt jelentenek például a természetes izotópok. Minden molekulaion-fragmens az alkotó elemeknek a természetes gyakoriságnak megfelelő többféle izotópjából épül fel. Ez többszörösére növeli a megjelenő ionok számát a spektrumban, hiszen az izotópok összes kombinációja előfordul majd a spektrumban. A példa kedvéért gondoljunk egy egyszerű CH3+ ionra; mivel a szénnek is két stabilis izotópja van (12C és 13C, kb. 100:1 relatív gyakorisággal), és a hidrogénnek is (1H és 2H, kb. 100:0,01 relatív gyakorisággal) ezért a CH3+ ion az izotópok összesen hat kombinációjaként fog keletkezni, ami öt, egymással átfedő csúcs megjelenését eredményezi minden spektrumban (m/z= 15, 16, 17, 18 és 19). Ezek közül természetesen az m/z= 15 csúcs lesz a legnagyobb intenzitású, azonban könnyen elképzelhető, hogy ez a körülmény mennyire komplikálja a nagyobb molekulák és a bonyolult fragmentációt eredményező ionizációs eljárásokkal felvett spektrumok kiértékelését, hiszen ilyenkor a lehetséges izotóp kombinációk száma is szaporodik. Ugyanakkor érdemes azt is megemlíteni, hogy izotópjelölt molekulák detektálását is lehetséges MS módszerrel végezni.
A tömegspektrumok nagy információtartalmának köszönhetően a kvalitatív tömegspektrometria alkalmazása igen széleskörű, mind önálló műszerként, mind más analitikai rendszerekhez kapcsolt detektorként (pl. TG-MS, HPLC- MS, stb.). Az alkalmazási területek a proteomikától az aeroszolok környezeti analitikáján át a szintetikus vegyületek minőségellenőrzéséig terjednek. A vezérlő elektronika és a vákuumtechnika fejlődésének köszönhetően ma már hordozható, terepen alkalmazható berendezéseket is készítenek.
Ismertesse a tömegspektrometriában alkalmazott legfontosabb ionizációs eljárások működési elvét!
Milyen tömeganalizátorokat alkalmaznak elterjedten a szerves vegyületek kvalitatív tömegspektrometriájának területén?
Milyen vegyületek analízisére a legalkalmasabb a MALDI-MS módszer?
Hogyan működik és mire alkalmas a tandem tömegspektrometria?
Hasonlítsa össze az ESI-MS és MALDI-MS módszerek analitikai jellemzőit!