A tömegspektrometriáról a jelen tananyagban több helyen is szó esik, ezért fontosnak tartjuk itt a tárgyalt módszerek közötti megkülönböztetés okát megnevezni. Érdemes leszögezni azonban azt is, hogy analitikai szempontból csak azok a módszerek alkalmasak kvantitatív célokra, amelyek elég szelektívek ahhoz, hogy kvalitatív célokat is szolgáljanak (más szavakkal: minden kvantitatív módszer egyben kvalitatív is, de fordítva ez nem igaz). Az atomi tömegspektrometriát, vagyis az elemek/izotópok tömegspektrometriáját (ICP-MS) az 6.2. fejezetben tárgyaljuk; ezt sokan szervetlen kvantitatív tömegspektrometriának nevezik. A szerves vegyületek, (bio)polimerek tömegspektrometriáját igen változatos műszerek szolgálják, amelyek az esetek többségében kvalitatív célokat (pl. vegyületek azonosítása, móltömeg-meghatározás, kémiai szerkezet valószínűsítése, stb.) szolgálnak – ezekről a módszerekről és alkalmazásokról a 7.1. fejezetben esik szó. Az alábbiakban a szerves vegyületek kvantitatív meghatározására alkalmas tömegspektrometriai módszerekről lesz szó.
A kvantitatív tömegspektrometria a leggyakrabban kromatográfiával kapcsolt műszerek formájában használatos (HPLC-MS, GC-MS), ezért az alábbiakban a működés részleteit ennek megfelelően, az interfész szerint bontva tárgyaljuk. A tömegspektrométer rész mindkét esetben lényegében azonos felépítésű, természetesen az egyes modulok (ionforrások, tömeganalizátorok) 3. fejezetben leírt variánsai mind előfordulhatnak.
A GC berendezések tömegspektrométerrel való összekapcsolása viszonylag egyszerű, hiszen a GC-ből távozó komponensek eleve gázfázisúak, ami az ionforrás és a tömeganalizátor működésével elvben kompatibilis. Egy tipikus, 0,25 mm belső átmérőjű kapillárison átfolyó jellemző gázáramlási sebességek is megfelelnek egy egyszerű MS vákuumrendszer terhelhetőségének. Természetesen fontos követelmény annak biztosítása, hogy a mintakomponensek az összekapcsolás során gázfázisban maradjanak, ezért a GC kimenetét (outlet) az MS rész bemenetével (inlet) összekötő transzport csőnek fűtöttnek és hőszigeteltnek kell lennie. Mindezek alapján lehetséges, és gyakran alkalmazott a leírt egyszerű, ún. direkt csatolás, azonban ez nem mentes a problémáktól. Az egyik komplikáció az, hogy ilyenkor a GC kolonna kimenete vákuumban lesz, ami szívó hatása miatt megváltoztathatja a más detektorral megállapított retenciós időket. Az MS rész szemszögéből pedig az az előnytelen, hogy a mintainjektálás és a GC fűtőprogram működése során az oldószerterhelés és a gázáramlási sebességek megváltoznak, ami az MS hangolási jellemzők (érzékenység) változásával jár. Emiatt egy másik alternatívát is kifejlesztettek, amit „open-split” csatolásnak neveztek el. Ennek a konstrukciónak a működését az alábbi ábra szemlélteti. A működés lényege, hogy GC outlet nem közvetlenül csatlakozik az MS inlethez, hanem a két kapilláris nyitott végei között egy kis távolságot hagynak; ezen nyílás körül pedig egy kamrában egy segédgázt áramoltatnak. Ezen segédgáz áramlás sebességének szabályzásával lehetséges kompenzálni a GC gázáramlás sebességének ingadozásait vagy hirtelen „lefúvatni” egy pillanatnyilag megnőtt oldószer terhelést. Mindemellett a GC outlet is atmoszférikus nyomáson lesz.
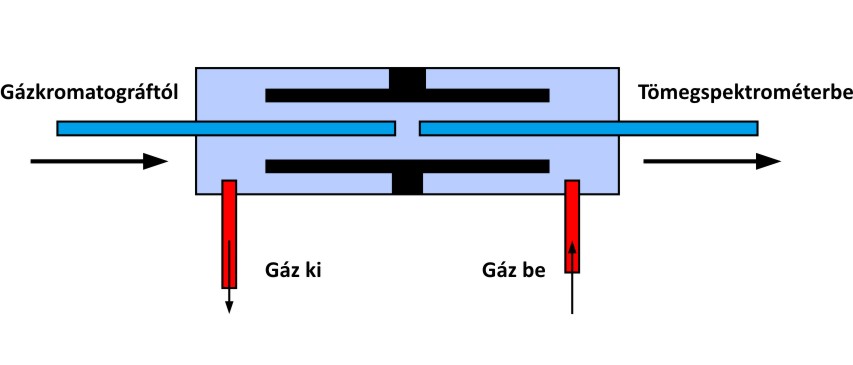
A GC-MS kapcsolásnál gyakran alkalmazott "open-split" interfész vázlatos felépítése
A HPLC-MS csatolás megvalósítása több okból kifolyólag is jóval komplikáltabb, mint a GC-MS csatolás. Ezen okok közül a legfontosabbak: a.) a mozgófázis összetétele (pl. foszfát puffer) gyakran inkompatibilis az MS rendszer működésével, b.) poláris és ionos komponensek átvitele a folyadékfázisból a gázfázisba nehézkes, c.) a HPLC mobil fázis teljes elpárologtatásából származó gázterhelés meghaladja az MS vákuumrendszer kapacitását. Az első probléma elhárítása a HPLC oldaláról lehetséges: illékony pufferek (pl. ammónium acetát) használatával vagy kolonna váltással kezelhető. A második problémát az új típusú ionforrások, elsősorban az electrospray és thermospray, kifejlesztése oldotta meg (lásd 3. fejezet). A harmadik probléma kezelésére többféle interfész rendszert dolgoztak ki, amelyek közül azonban egyik sem alkalmas minden mérendő komponens és mozgófázis kezelésére. A legtöbb kereskedelmi műszerben atmoszférikus nyomáson működő kémiai ionizációt (atmospheric pressure chemical ionization, APCI) alkalmaznak, mivel ennek működése egyszerű, robusztus és viszonylag hatékony. Az APCI interfész egy thermospray porlasztóval, nagy nitrogéngáz áramlás mellett viszonylag magas hőmérsékleten (kb. 400 ° C) aeroszollá illetve gőzzé alakítja a mozgőfázist, majd egy elektromos kisüléssel ionizálja a cseppeket/gőzöket. Egy másik elterjedt interfész (electrospray interface, ESI) működése közvetlenül az electrospray porlasztó működésén alapul; ez egyszerre porlasztó és ionforrás, hátránya azonban hogy az ionizáció a folyadékfázisban zajlik, ami poláris mozgőfázisok esetén és adalékok használatával működik csak hatékonyan. Az APCI megengedi a szokásos fordított fázisú HPLC technikában használt apoláris oldószerek használatát, viszont agresszívebb (keményebb) ionforrás, mint az ESI, így általában a mérendő komponensek nagyobb fragmentációját okozza.
A tömegspektrometriás analízisben általában egy mintabeli kémiai komponens sikeres azonosításához több csúcs (m/z) jelenléte és azok intenzitásarányának megfelelő értéke szükséges. A kvantitatív meghatározáshoz ezért általában nem nyújt elegendő megbízhatóságot egyetlen csúcs intenzitásának (vagy csúcs alatti területének) mérése és kalibrálása. Így, bár az utóbbi, ún. szelektív ion monitorozás üzemmód (selective ion monitoring, SIM) nyilvánvalóan gyorsabb mérési időket és/vagy a nagyobb akkumulációs időkön keresztül jobb jel/zaj viszony elérését (alacsonyabb kimutatási határokat) tesz lehetővé, nem megbízható megoldás. A másik végletet a teljes tömegspektrum felvétele (full scan) jelenti, amely lehetőséget ad a szelektív mérés feltételeinek ellenőrzésére. Kompromisszumos megoldás lehet néhány ioncsúcs szelektív monitorozása. Nehezedik a helyzet, amikor „lágy” ionizációs eljárást alkalmaznak a mintabevitelnél (pl. electrospray), amikor kisebb mértékű a vegyületek fragmentációja az ionizáció során, tehát egy vegyülethez sokkal kevesebb (esetleg összesen egy) csúcs tartozik. Ez főként HPLC-MS csatolásnál jelentkező probléma, amelyre leginkább az MS-MS detektorok alkalmazása és ezáltal szelektív reakciótermékek figyelése jelent megoldást.
Bármilyen kalibrációs módszert is alkalmaz az analitikus a kvantitatív MS mérés során, a belső standard jelkorrekciós eljárás alkalmazása előnyös. Alkalmas belső standard mintához való hozzáadása révén nemcsak a mintaelőkészítés és a kromatográfiás elválasztás, hanem az ionizáció hatékonyságának fluktuációja is nagymértékben korrigálható. Közel ideális belső standard választást jelent az izotópjelölt molekulák alkalmazása; hiszen ezek külön (szatellit) csúcsokat fognak a tömegspektrumban produkálni.
A kvantitatív GC-MS és HPLC-MS módszerekkel a komponensek 10-100 pg tömegei már detektálhatóak, az alkalmazott tömeganalizátortól és ionizációs módszertől is függően. A gyakorlati analízisek során természetesen nem annyira a legkisebb detektálható abszolút tömegek, hanem sokkal inkább a koncentrációban kifejezett kimutatási határok a fontosak, amelyek a mintaelőkészítést és egyéb méréstechnikai körülményeket is magukban foglalják. A megbízható, rutinszerű kimutatási határok tipikusan a µg/L koncentráció tartományba esnek.
A kapcsolt kromatográfiás technikák, ezen belül is a tömegspektrometriás analízisek egyre nagyobb népszerűségnek örvendenek. A kvantitatív alkalmazások gyakorisága a fent is említett nehézségek miatt elmarad a kvalitatív alkalmazásokétól. A kvantitatív HPLC-MS módszert elsősorban bioanalitikában, proteomikában, gyógyszerkutatásban, orvosi diagnosztikában használják. A kvantitatív GC-MS módszer fő alkalmazási területei a környezetvédelmi mérések (pl. ivó- és szennyvizek szennyezőanyagainak mérése), drogok/gyógyszerek és azok metabolitjainak vizsgálata vérben és vizeletben gyógyszerkutatási és bűnügyi célokra, ipari minőségellenőrzés.
Milyen technikai problémákat és megoldásokat ismer a GC-MS kapcsolással összefüggésben?
Milyen technikai problémákat és megoldásokat ismer a HPLC-MS kapcsolással összefüggésben?
Milyen megfontolásokat érdemes tenni a szelektív és kvantitatív GC-MS vagy HPLC-MS analízis kivitelezése előtt?
Soroljon fel néhány alkalmazási területet a kvantitatív GC-MS módszer számára!
Az MS-MS detektor alkalmazásának mikor van leginkább létjogosultsága a kvantitatív analízis területén?