A XIX. század elején figyelték meg azt a jelenséget, hogy egy kvarcprizmán áthaladó, síkban polarizált fény rezgési síkja a prizmából kilépve bizonyos szöggel elfordul. Jean Baptiste Biot volt az, aki kvarckristályok hasítása során észrevette, hogy egyes kristályok jobbra, mások balra forgatják el a polarizált fény síkját. Az olyan anyagokat, amelyek a polarizált fény rezgési síkját elforgatják, optikailag aktívnak, magát a jelenséget optikai aktivitásnak nevezték el. Ezt a jelenséget kezdetben csak a kristályos anyagok szerkezetének aszimmetriájával hozták összefüggésbe, csak később, főként Louis Pasteur munkásságának köszönhetően sikerült tisztázni, hogy a jelenség a molekuláris szinten megjelenő aszimmetria meglétéhez kötődik.
Egy négy különböző csoporttal helyettesített szénatomot tartalmazó molekula nem rendelkezik szimmetriaelemmel, létrejön egy aszimmetriacentrumot tartalmazó, optikai aktivitást mutató, ún. királis vegyület, melynek két, egymással fedésbe nem hozható tükörképi szerkezete lehetséges. Ezeket a királis molekulákat, amelyek tehát egymásnak tükörképi párjai, de egymással nem hozhatók fedésbe (hasonlóan például a kezünkhöz) enantiomereknek nevezzük. (Az optikai aktivitás jelensége nincs az aszimmetrikus szénatomhoz kötve, feltétele csupán az, hogy a molekulának ne legyen tükrözési szimmetriaeleme.)
Ma már tudjuk, hogy az élő szervezetekben a királis molekulák kiemelkedő jelentőséggel bírnak. A fehérjék, a fehérjéket alkotó aminosavak, a cukrok, az enzimek királis vegyületek. A pontos magyarázat még ma sem ismeretes, de ezen molekulák kép-tükörkép párosából az esetek döntő többségében a természetben csak az egyik forma fordul elő. A királis molekulák világában az enantiomerek biológiai hatása nagymértékben különbözhet egymástól. Ennek a megállapításnak a királis gyógyszermolekulák esetében óriási jelentősége van, hiszen amíg az enantiomer molekulapárok egyik tagja pozitív hatást fejt ki az emberi szervezetben, addig a másik hatástalan, rosszabb esetben akár kedvezőtlen biológiai hatást is eredményezhet.
Az enantiomerpárok elválasztása tehát kiemelkedő jelentőséggel bír mind a gyógyszeranalitikában, mind az élettudományok számos területén. Az enantiomerek fizikai és kémiai tulajdonságbeli hasonlóságuk miatt elválasztásuk csak olyan sztereospecifikus kémiai kölcsönhatással lehetséges, amelynek során a sztereoizomerek eltérő módon reagálnak. A kromatográfiás királis elválasztás alapja a diasztereomerpár-képzés a vizsgált vegyület és az állófázis vagy a mozgófázis királis alkotója között. A nagyhatékonyságú folyadékkromatográfia a mozgó-, illetve az állófázisok egyszerű változtatása révén a királis vegyületek megkülönböztetésére leggyakrabban alkalmazott analitikai módszer.
Az optikai izomerek elválasztására alkalmazható módszereket két fő típusba sorolhatjuk: 1.) közvetett meghatározás (oszlop előtti származékképzés királis reagenssel), 2.) közvetlen meghatározás (királis eluens alkalmazása vagy királis állófázis alkalmazása).
Manapság számos kedvező tulajdonsága miatt a királis állófázis alkalmazását részesítik előnyben. A királis HPLC oszlopok létrehozása bizonyos szerves vegyületek kiválasztott enantiomerjének állófázishoz (pl. szilikagél) való kötésével történik. Az elválasztás hatékonysága az így kialakított királis felületen képződő diasztereomer párok eltérő kötéserősségétől függ. A stabilabb diasztereomert kialakító vegyület visszatartása nagyobb, így a kevésbé stabil diasztereomer eluálódik először, amint azt az alábbi animáció szemlélteti.

Királis elválasztás
Az enantiomer-megkülönböztető képesség (ún. enantioszelektivitás) azon alapszik, hogy egy királis molekula eltérő kölcsönhatásba lép egy másik királis molekula két enantiomerjével. Ez az eltérés megnyilvánulhat a gazdamolekula és a vendégmolekula között létrejött komplexek stabilitásában (ún. termodinamikai kontroll), a komplexképződés sebességében, ill. a már kialakult komplexek disszociációjának sebességében (ún. kinetikus kontroll).
A módszer nagy előnye, hogy nem igényel hosszadalmas és bonyolult mintaelőkészítést, valamint az analízis után a vegyületek eredeti formájukban állnak rendelkezésünkre. A királis oszlopok alkalmasak analitikai mérések kivitelezésére minőségi, mennyiségi meghatározás céljából, valamint fél-preparatív ill. preparatív oszlopokkal enantiomer tisztításra is.
Általában három féle halmazállapotot (gáz, folyadék, szilárd) szoktunk megkülönböztetni, fizikai-kémiai tanulmányaik során azonban már találkoztak egy negyedikkel is, amikor az anyagot a kritikus hőmérséklete fölé melegítve a kritikus nyomás feletti értéket biztosítva létrejön az ún. szuperkritikus állapot. Ilyen körülmények között az anyagok bizonyos tulajdonságai részben a gázokéra (pl. viszkozitás), részben pedig a folyadékokéra (pl. sűrűség) emlékeztetnek, míg vannak olyan jellemzőik is (pl. diffúziós állandó), amelyek a gáz- illetve folyadék állapot között helyezkednek el. Régen felismerték, hogy az ilyen szuperkritikus folyadékok kiválóan alkalmazhatók oldószerként különféle kémiai műveletek (pl. extrakció) során.
A szuperkritikus folyadékkromatográfia (Supercritical Fluid Chromatography, SFC) olyan elválasztástechnikai módszer, ahol a mozgófázis szuperkritikus folyadék. Egy ilyen folyadék mozgófázisként történő alkalmazása többféle előnnyel is jár:
kicsi a viszkozitás: kicsi a kialakuló nyomás, azaz hosszabb kolonna készíthető
nagy diffúziós együttható: gyorsabb, hatékonyabb elválasztás érhető el
Ugyan elvileg többféle anyag eluensként történő alkalmazása is szóba jöhet, számos előnye miatt leggyakrabban szén-dioxidot használnak szuperkritikus folyadékként. A szén-dioxid szuperkritikus folyadékként történő alkalmazásának előnyei a következők:
kémiailag inert,
nagy a sűrűsége,
sok anyagot tud oldani,
alacsony a kritikus hőmérséklete (31°C) és kritikus nyomása (73 bar), ezért technikailag viszonylag könnyen biztosítható a kritikus állapot,
a szobahőmérséklettől alig különböző hőmérsékleten nem kell a mintát alkotó komponensek hőbomlásától tartani,
nem tűzveszélyes és nem korrozív,
megfelelő tisztaságban olcsón beszerezhető,
nagy mennyiségben áll a rendelkezésre,
nem káros az egészségre,
nem szennyezi a környezetet,
a nyomás és hőmérséklet megfelelő változtatásával lehetőség van a szuperkritikus állapotú oldószer oldóképességének változtatására,
polaritása „hangolható” szerves adalékok (pl. metanol, etanol, acetonitril, hangyasav, stb.) segítségével.
Érdekességképpen jegyezzük meg, hogy napjainkban két eltérő technika szolgál az SFC mérés kivitelezésére; kapilláris SFC-ről akkor beszélünk, ha kapilláris oszlopot használunk módosított gázkromatográffal, töltetes SFC-ről pedig akkor, ha HPLC állófázisokat alkalmazunk módosított folyadékkromatográffal.
Töltetes SFC esetén állófázisként a HPLC technikánál megismert töltetek (leggyakrabban C18) jöhetnek szóba. Az SFC technikai megvalósítására a HPLC készülékkel analóg módon kialakított kromatográf alkalmas. Eluenstárolóként ebben az esetben egy szén-dioxid palack szolgál, emellett ugyanúgy mint a HPLC-nél, itt is szükség van pumpára, adagolóra, detektorra. A kromatográf működését az alábbi animáció szemlélteti.

Egy szuperkritikus kromatográf felépítésének és működésének sémája
A szén-dioxid palackból kiáramló eluens a megfelelő módosítókkal összekeverve áthalad a mintaadagolón, majd az oszlopon, ahol megtörténik a mintát alkotó komponensek elválasztása. Ezt követi a detektálás, majd a detektor jelének kromatogrammá történő átalakítása.
Amint a módszer ismertetését követően sejthető, az SFC alkalmazási köre részben a gáz-, részben pedig a folyadékkromatográfiával van fedésben, azaz környezeti minták elemzésétől a gyógyszer-analitikáig sokféle területen bevethető. A gyakorlati alkalmazásai közül elsősorban azon analitikai problémákat érdemes kiemelni, amelyeknél különböző okok miatt se a gáz-, se a folyadékkromatográfia nem tud érdemi megoldást biztosítani. Ilyen például a nagy molekulasúlyú szénhidrogének meghatározása, amelyek kicsiny illékonyságuk miatt közvetlenül nem igazán gázkromatografálhatók, míg a folyadékkromatográfiás meghatározás detektálási nehézségek miatt nem kivitelezhető.
A nagyhatékonyságú folyadékkromatográfia roppant széleskörű elterjedését többek között annak köszönheti, hogy nagyon széles spektrumon változtatható az álló- és mozgófázis polaritása, így a legkülönbözőbb vegyületek analízise elvégezhető segítségével. Normálfázisú rendszerekben apoláris, fordított fázisú rendszerekben tipikusan közepesen poláris komponensek vizsgálhatók. Azonban a nagyon hidrofil (illetve nagy polaritású) vegyületek esetében egyik korábban megismert rendszer sem alkalmazható megfelelő hatékonysággal. A hidrofil kölcsönhatások kialakítására építő HILIC (Hidrophilic Interaction Liquid Chromatography, HILIC), ezen főként nagy polaritású és ionos anyagok meghatározására alkalmas módszer, így a folyadékkromatográfiás meghatározások köre alkalmazásával még tovább bővíthető.
HILIC esetén tipikusan acetonitril és víz alkotja a mozgófázist, méghozzá úgy, hogy az eluens víz tartalma 2-40 (v/v%) között változik, ellentétben a fordítottfázisú rendszerekkel, itt a víz számít erősebb oldószernek. Ennél a kromatográfiás módszernél a mozgófázis minden esetben kell, hogy vizet tartalmazzon, hiszen az elválasztás alapja az, hogy a poláris állófázis felületén kialakul egy vízben gazdag réteg, és így megoszlás jön létre az állófázis felületén (illetve annak közelében) elhelyezkedő vizes és a mozgófázis kevésbé poláris (acetonitrilben gazdagabb) fázisa között, amint azt az alábbi animáció szemlélteti.
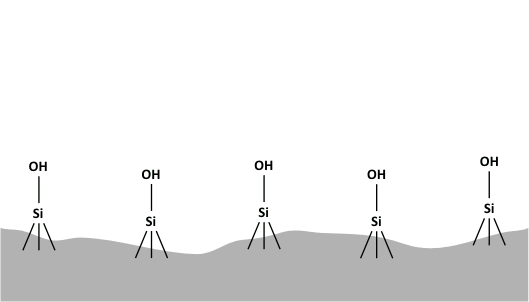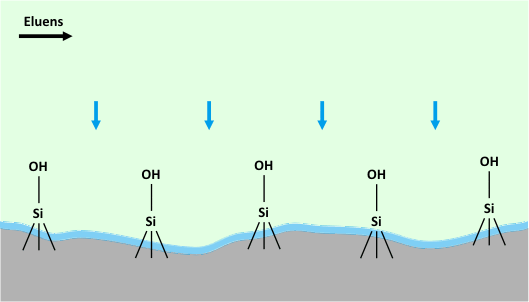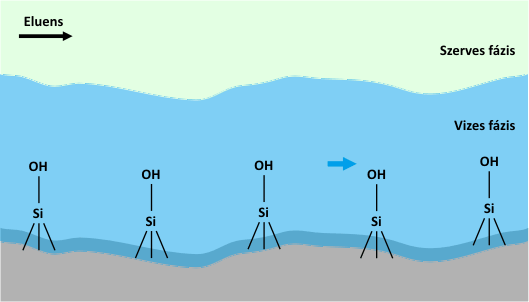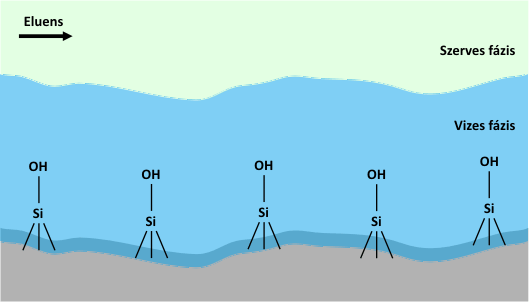
A HILIC módszer működésében központi szerepet játszó vizes réteg kialakulása
Mint általában a folyadékkromatográfiás meghatározásoknál itt is szükség lehet a megfelelő pH beállítására. Erre a célra leggyakrabban ammónium-acetát, illetve ammónium-formiát puffert alkalmaznak.
Az állófázisok kapcsán elmondható, hogy akár töltés nélküli (pl. szilikagél, amino-, ciano- vagy diolcsoporttal módosított szilikagél) akár töltéssel rendelkező (pl. ioncserélők), akár ún. ikerionos töltetek használhatóak HILIC módban, egyetlen követelmény az, hogy az állófázisnak elegendő hidrofilitással kell rendelkeznie ahhoz, hogy az elválasztásban kitüntetett szerepet betöltő felületi vizes fázis kialakulhasson.
A HILIC ugyan hosszabb múltra tekinthet vissza, de igazából csak napjainkban kezdett szélesebb körben elterjedni. Előnyei között mindenképpen említést érdemel, hogy a HPLC technikánál megismert detektálási módok szinte mindegyikével kompatibilis, így elmondható, hogy alkalmazásával nem egyszerűen csak a vizsgálható vegyületek száma növelhető, hanem egy-egy detektálási technika alkalmazhatósága is kiterjeszthető.
A folyadékkromatográfiás módszerekkel szemben megfogalmazott különböző elvárások között a megfelelő szelektivitás biztosítása mellett napjainkban főként a nagy-áteresztőképesség és a megnövelt hatékonyság kialakítására helyezik a legnagyobb hangsúlyt. Ezen célok eléréséhez olyan töltetek kifejlesztése vált szükségessé, melyek az elméleti tányérszám jelentős növelésén keresztül rövidebb analízis idővel (lehetőleg kevesebb oldószer felhasználásával) tudják biztosítani ugyanazt vagy akár nagyobb felbontóképességet.
Az elméleti tányérszám növelésének (avagy a tányérmagasság csökkentésének) egyik lehetősége a töltetet alkotó szemcsék méretének csökkentése. Korábban 10, napjainkban általában 5, de egyre inkább 3 µm szemcseátmérőjű tölteteket alkalmaznak, mindemellett megjelentek már a 2 µm-nél kisebb szemcseméretű töltetek is. A méretcsökkentésnek azonban hátrányai is vannak, a szemcseméret csökkentésével négyzetesen nő az oszlopon eső nyomás. Mivel a napjainkban alkalmazott HPLC készülékeket 400 bar nyomásra tervezték, ezekkel a készülékekkel már nem lehetséges a legújabb fejlesztésű oszlopok nyújtotta előnyök kiaknázása. Ezen új kolonnák csak a nagyobb (800-1200 bar) nyomástartományban működő UHPLC (ultra high pressure liquid chromatography) rendszerekkel kompatibilisek.
A hatékonyság növelésének másik, gyakorlati szempontból komoly jelentőséggel bíró lehetősége a héjszerkezetű töltetes kolonnák alkalmazása. A héjszerkezetű szemcsék kifejlesztése egy magyar kromatográfus, Horváth Csaba nevéhez fűződik, aki a 60-as évek végén már készített 50 μm-es átmérőjű héjszerkezetű tölteteket. (Horváth Csaba ezt „pellicular” töltetnek nevezte el.) Sokáig azonban nem sikerült kisebb szemcseátmérővel előállítani ezeket a tölteteket, így egy jó darabig ez a kiváló ötlet fiókba került. Az első 3 µm-nél kisebb átmérőjű, kereskedelmi forgalomban kapható héjszerkezetű töltet 2007-ben jelent meg (Ascentis Express, Halo), ezt 2009-ben követte a napjainkban legnagyobb számban értékesített héjszerkezetű töltettel rendelkező kolonna (Phenomenex, Kinetex) forgalomba kerülése.
A folyadékromatográfiában leggyakrabban alkalmazott nagy fajlagos felületű porózus töltetek felhasználásával igen jól terhelhető, azaz nagy mintakapacitással rendelkező kolonnák készíthetők. Ebben az esetben a molekulák diffúzióval jutnak be a pórusok belsejébe, és diffúzióval jutnak vissza a mozgófázisba, így az álló- és mozgófázis között lejátszódó anyagtranszport viszonylag lassan megy végbe, ami csúcskiszélesedést, azaz hatékonyság csökkenést eredményez. Velük ellentétben a nem porózus, azaz tömör részecskék alkalmazásának az az előnye, hogy az elválasztandó molekulák az állófázis felületével hatnak kölcsön, mivel nincsenek pórusok, így az előbb említett diffúzió-kontrollált anyagátmenet elhanyagolható, éles csúcsok jelennek meg a kromatogramon. Hátrányuk viszont, hogy a kicsiny felület miatt kicsi lesz a mintakapacitás.
A héjszerkezetű töltetek a porózus és a nem porózus töltetek előnyeit ötvözik úgy, hogy egy megfelelő átmérőjű tömör mag köré építik föl a meghatározott átmérőjű porózus héjat. Egy ilyen szemcse szerkezetét mutatja az alábbi ábra.
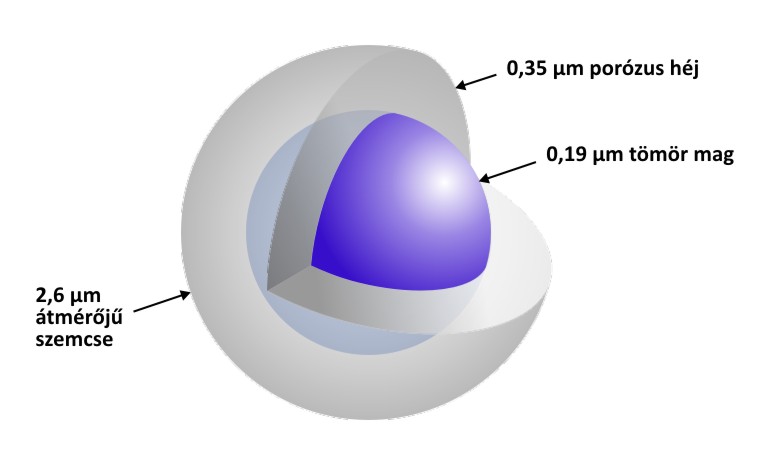
Egy héjszerkezetű töltet szemcse metszete
A héjszerkezetű töltet alkalmazásával a porózus töltethez képest kisebb diffúziós úthossz, azaz gyorsabb anyagátadás érhető el, míg a tömör részecskéknél lényegesen nagyobb mennyiségű minta vihető fel. Így végső soron megfelelő nagyságú, éles csúcsok jelennek meg a kromatogramon, javítva mind a kimutatási határt, mind a felbontást a hagyományos HPLC készülékekkel kivitelezhető körülmények (p<400 bar) között. (Mára már tudományos publikációk igazolták, hogy a 2,6 µm-es héjszerkezetű töltetekkel hasonló tányérszámok érhetők el, mint a 2 μm-nél kisebb, teljesen porózus szemcsékkel, lényegesen kisebb nyomáson.)
A korábbi tanulmányaik során megismert kromatográfiás technikáknál egy-egy komponens visszatartásához, illetve a többi alkotótól történő elválasztásához elengedhetetlen az állófázis és az adott komponens között kialakuló fizikai vagy kémiai kölcsönhatás, illetve valamely dinamikus egyensúly létrejötte a mintakomponensre nézve az álló és a mozgófázis között. Ezzel ellentétben a méretkizárásos kromatográfia (Size Exclusion Chromatography, SEC) esetén a különféle vegyületek elválasztásának alapja a molekulák mérete. Mivel a molekulák fizikai mérete függ az alkalmazott oldószertől, amelynek változtatása minden kromatográfiás technikánál az elúció alapját képezi, ezért az átmérő, illetve sugár helyett a mérettel arányos molekulatömeget szokás egy-egy töltet jellemzésére megadni.
A méretkizárásos kromatográfia olyan pórusos töltettel rendelkező kolonnákat használ az elválasztás során, ahol (ideális esetben) semmilyen kölcsönhatás nem jön létre az állófázis és a mintát alkotó komponensek között. Ehhez tipikusan porózus (makropórusos) tölteteket alkalmaznak (pl. szilikagél, módosított szilikagél, szerves polimerek).
Az alkalmazni kívánt mozgófázissal szemben megfogalmazott legfontosabb követelmény az, hogy benne a vizsgálandó minta megfelelő mértékben oldódjon, illetve az, hogy az eluensként alkalmazni kívánt oldószer(elegy) ne változtassa meg az állófázis elválasztás szempontjából fontos tulajdonságait.
A méretkizárásos kromatográfia működési elvét az alábbi ábra szemlélteti.
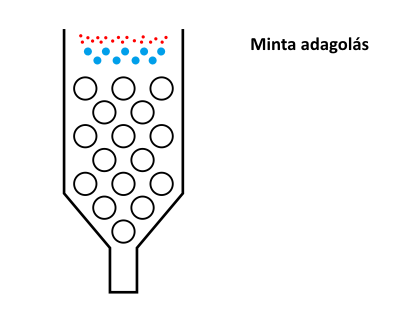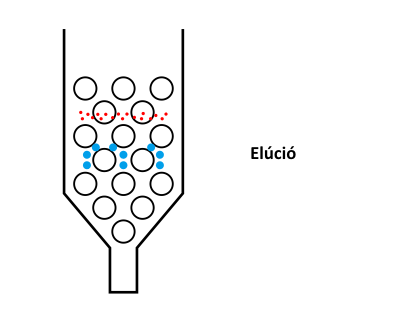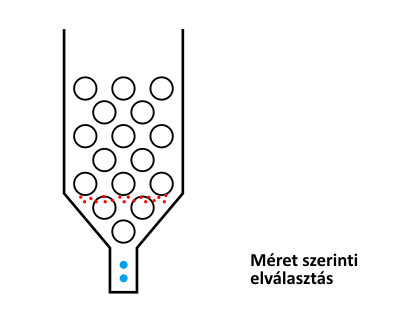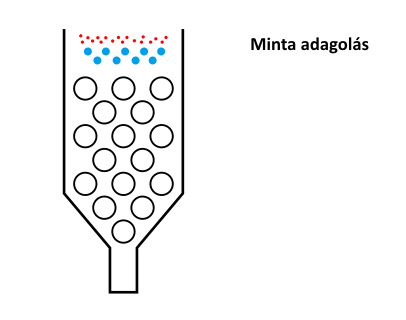
A méretkizárásos kromatográfia működési elve
A különböző méretű pórusokkal rendelkező töltetre felvitt mintát alkotó komponensek közül a legnagyobb méretű molekulák, amelyek egyetlen pórusba sem férnek bele, azaz kizáródnak, vagyis a mozgófázis sebességével haladnak végig a tölteten. (Ezt a méretet, helyesebben tömeget, kizárási méretnek nevezik. Ebben az esetben a kizárt molekulák retenciós ideje adja meg a holtidőt.) A kizárási tömegnél kisebb méretű molekulák már bizonyos pórusokba beleférnek, azaz visszatartódnak. (Az adott töltet által vizsgálható (azaz visszatartott) tömegtartományt nevezik mérési vagy működési tartománynak.) Minél kisebb a molekula mérete, annál több pórusba fog beleférni, azaz annál nagyobb lesz a retenciós ideje. Egy bizonyos mérettel rendelkező molekula már minden pórusba befér, azaz tovább csökkentve a molekula méretét nem tapasztalunk további retenciós idő növekedést.
A méretkizárásos kromatográfiával általában nagy molekulatömegű (102-108 Da) biopolimerek, peptidek, enzimek, szerves polimerek, lágyítók vizsgálhatók.
Az elválasztástechnikai módszerekkel szemben megfogalmazott elvárások napjainkban is szükségessé teszik olyan új technikák kidolgozását, melyek egyre szelektívebben képesek felismerni a célvegyületeket, egyre összetettebb rendszerek egyre kisebb mennyiségből történő elemzésekor. Az affinitás kromatográfia bizonyos biológialilag fontos vegyületek specifikus meghatározását teszi lehetővé hagyományos kromatográfiás technika (HPLC) alkalmazásával.
Az affinitás kromatográfia specifikus biológia kölcsönhatások kiaknázásán alapuló kromatográfiás módszer. Az elválasztás az állófázishoz kötött biomolekulák és a mozgófázisba juttatott molekulák között kialakuló biokémiai kölcsönhatásokon alapul, melyek a következők lehetnek:
antigén – antitest
enzim-inhibítor
hormon-hordozó
Az elválasztásért felelős állófázis kialakítása úgy történik, hogy a megfelelő hordozóra (pl. szilikagél) kémiailag rögzítik az enziminhibítort, vagy valamely fehérje-specifikus antitestet, ami képes az említett biokémiai kölcsönhatásokon keresztül a célvegyület specifikus felismerésére. Az állófázishoz nem kötődő komponensek gyorsan eluálódnak, majd a mozgófázis helyes megválasztásával (a kialakult specifikus kölcsönhatás megszüntetésével) elérhető a megkötött komponensek elúciója.
Az affinitás kromatográfiát nemcsak a fentebb leírt módon, hanem igen gyakran mintaelőkészítésként tisztításra is alkalmazzák.
Milyen lehetőségeket ismer királis vegyületek folyadékkromatográfiás meghatározására?
Mi az alapja az állófázisok enantiomer-megkülönböztető képességének?
Mit nevezünk szuperkritikus állapotnak?
Milyen előnyei vannak a szén-dioxid mozgófázisként történő alkalmazásának?
Milyen vegyületek analízisére alkalmas a hidrofil kölcsönhatáson alapuló folyadékkromatográfia?
Ismertesse az elválasztás mechanizmusát hidrofil kölcsönhatáson alapuló folyadékkromatográfia esetén!
Milyen lehetőségek vannak a nagyobb hatékonyság elérésére a folyadékkromatográfiás állófázisok esetében?
Mi a héjszerkezetű töltet szerepe?
Ismertesse a méretkizárásos kromatográfia lényegét!
Ismertesse az affinitás kromatográfia működési elvét!