A kapilláris elektroforézis (CE) módszerét egy svéd tudós, Tiselius alkalmazta elsőként 1937-ben. Az azóta eltelt időnek és fejlődésnek köszönhetően napjainkban a CE egy igen gyakran alkalmazott elválasztástechnikai módszerré vált. Előnyei közé sorolható, hogy nagyon kis mintamennyiséget igényel (1-10 nL), könnyen automatizálható, rövid az analízisidő, egyszerű a készülék felépítése, valamint rendkívül széleskörűen alkalmazható.
Az elektroforézis a töltéssel rendelkező részecskék valamilyen vezető közegben, elektromos erőtér hatására történő elmozdulásaként definiálható. Az elektroforetikus elválasztás alapja, hogy elektromos térben az oldott anyagok különböző sebességgel vándorolnak. A kapilláris elektroforézis esetében az elektroforézis egy kis belső átmérőjű, puffer oldattal töltött kapillárisban történik. Ebben az esetben az elektroforetikus elválasztás működésének alapja az elektroozmotikus áramlás (electroosmotic flow, EOF), amely a folyadék elektromos tér hatására valamely töltéssel bíró felület mentén kialakuló elmozdulásaként definiálható. Az EOF minden olyan esetben fellép, ahol valamely töltött felülettel érintkező folyadékra feszültséget kapcsolunk. Nagyságát és irányát nagyban befolyásolja a kapilláris anyaga és a kapillárisban lévő oldat jellege.
Napjainkban vizes oldatokat és kvarc kapillárist alkalmaznak leggyakrabban a kapilláris elektroforézisen alapuló elválasztásoknál. Vízzel érintkezve a kvarc kapilláris belső felületén szilanolcsoportok alakulnak ki, amelyek pH>2,5 felett disszociálnak, így negatív töltésű felület jön létre, amely vonzza a pozitív ionokat az elektrolitoldatból, és ezek a pozitív ionok a jelenlévő elektromos erőtér hatására a katód felé mozdulnak el, magukkal ragadva az oldatösszetevőket, amint azt az alábbi animáció szemlélteti.

Az elektroozmózis jelensége
Az elektroozmózis által létrejött folyadékáram dugószerű áramlási profilt alakít ki. Mivel a kapillárisban az áramlás hajtóereje mindenütt megegyezik, csak a kapilláris falának közvetlen közelében csökken nullára az áramlási sebesség, így nem okoz jelentős zónakiszélesedést a folyadékkromatográfiás technikákkal ellentétben.
Az oldatokban ez az elmozdulás a feszültség alkalmazásakor bekövetkező elektromos vezetés során alakul ki, az elválasztás pedig az ionok eltérő vándorlási sebességének következtében lehetséges. Alapesetben a mintabevitel a pozitív elektródnál, azaz az anódnál történik, pozitív feszültség alkalmazásával. Ekkor katód irányú áramlás jön létre, így a szintén katód felé mozgó kationok nagyobb sebességgel mozognak (komigrálnak), az anionok pedig ellentétes irányban haladnak (kontramigrálnak), ahogyan azt az alábbi ábra mutatja.
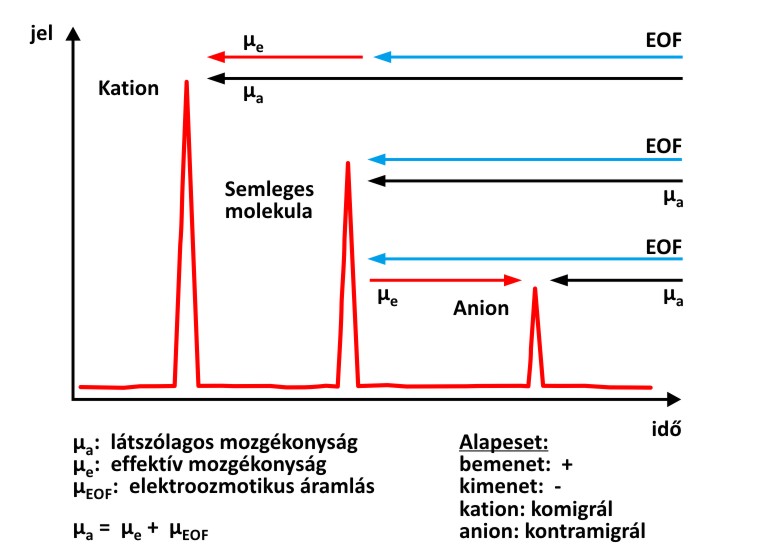
Anionok és kationok elektroozmotikus vándorlása
Az anionok értelemszerűen csak akkor detektálhatók, ha a mozgékonyságuk abszolút értelemben véve kisebb, mint az EOF. Ezek alapján alaphelyzetben először a kationok, utánuk a semleges molekulák, majd az anionok jelennek meg az ún. elektroferogramon. Abban az esetben, ha a polaritást megfordítjuk, csak az anionokat fogjuk detektálni.
A kapilláris elektroforézis készülékben egy kicsiny (20-100 μm) belső átmérőjű, 20-100 cm hosszú, puffer oldattal töltött kvarc kapilláris végei puffer oldatokba merülnek. Az injektálás általában a detektortól távolabb eső kapilláris végénél történik. A mintabevitel a kapillárisba egy puffertartó edénynek a mintát tároló edénnyel való kicserélésével, majd ezt követően külső nyomás illetve elektromos tér alkalmazásával történik. A puffertartó edény visszahelyezése után 5-30 kV nagyságú feszültséget alkalmazva, az elektromos tér hatására a minta komponensei vándorolni kezdenek. A készülék felépítését az alábbi ábra mutatja.
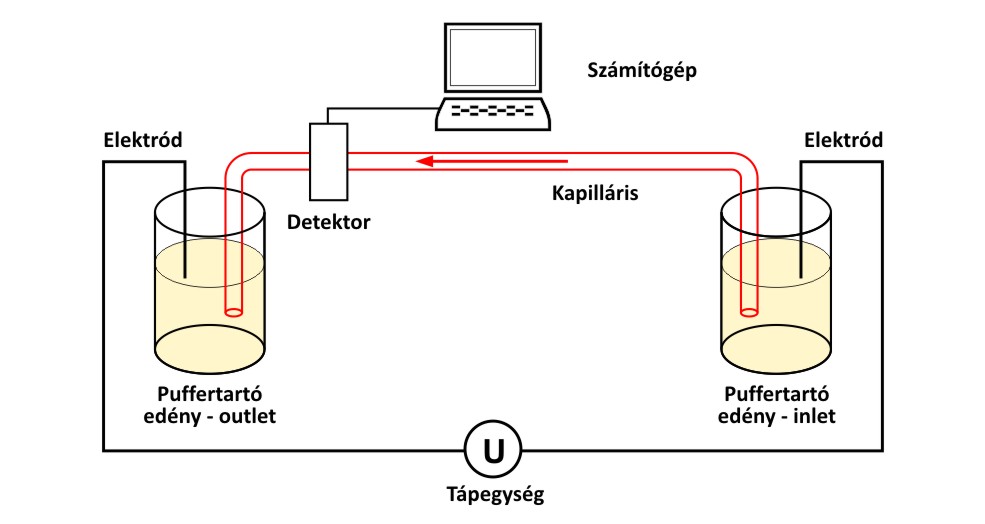
A kapilláris elektroforézis készülékek felépítése
A CE technikáknál a kapilláris kis átmérője és a felhasznált nanoliternyi térfogatú minta miatt a detektálás igen nagy kihívást jelent. Az ideális detektornak megfelelő érzékenységgel, kimutatási határral, kicsiny zajjal, elegendően nagy lineáris tartománnyal és gyors válaszidővel kell rendelkeznie. Számos, a HPLC technikánál korábban alkalmazott detektálási módszert próbáltak ki a CE esetén is. Ezek közül leggyakrabban az UV-Vis fényabszorpciós és a fluoreszcenciás detektálás használatos.
A detektálás hatékonysága úgy javítható, ha növeljük a kapilláris átmérőjét; ez azonban hatással van az áramerősségre is. Ha az átmérőt a kétszeresére növeljük, akkor a jel intenzitása is megkétszereződik, az áramerősség viszont a négyszeresére nő, ez pedig a kapilláris túlzott felmelegedését idézheti elő. Ennek elkerülése érdekében olyan speciális kapillárist fejlesztettek ki, amelynek átmérőjét csak a detektálási helyen növelték meg, ez az ún. buborékcella. Az elnyelési fényút hosszának növelésére szolgál az ún. Z-cella is, amelynek kialakítása olyan, hogy a folyadékot be- és elvezető kapillárisvégek között egy azokra merőleges (a fényútban elhelyezett) szakaszt iktatnak be, amelynek tengelyében történik a fényabszorpció mérése. Ez a megoldás a fényút hosszának jelentős (akár tízszeres) növelésére ad lehetőséget. A buborék- és a Z-cella kialakítását az alábbi ábrákon szemléltetjük.
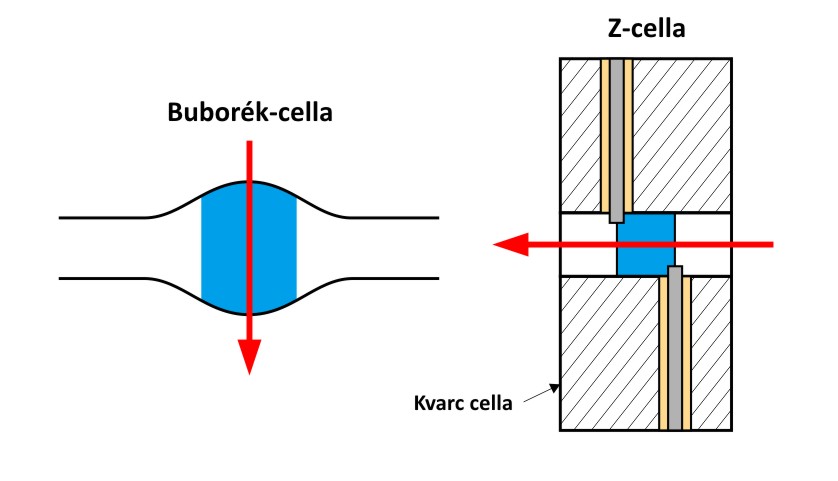
A buborék- és a Z-cella felépítése
A kapilláris anyagának kémiailag és elektromosan inertnek, UV és látható fényt áteresztőnek, hajlékonynak, de ugyanakkor kellően szilárdnak kell lennie. A CE technikáknál leggyakrabban spektrofotometriás detektálást alkalmaznak, így fontos követelmény az is, hogy a kapilláris anyaga ne nyeljen el az UV-Vis tartományban. Jelenlegi ismereteink szerint ezen követelményeket a kvarc kapilláris elégíti ki leginkább. A kvarc kapillárisokat poliimid védőréteggel borítják be, ezzel biztosítva a kapilláris mechanikai szilárdságát és könnyű kezelhetőségét (ez a külső bevonat a detektálás helyén könnyen eltávolítható, például égetéssel).
A CE-nél a nagyfokú reprodukálhatósághoz állandó feszültséget kell biztosítani. A megfelelő (5-30 kV) feszültség és áramerősség (3-300 µA) eléréséhez egyenáramú tápegység használatos, melynél az alkalmazott polaritás változtatható. A leggyakrabban alkalmazott körülmények mellett az elektroozmotikus áramlás (EOF) a katód felé irányul, ekkor a mintabevitel az anódnál történik. Amennyiben az EOF-et meg kívánjuk fordítani, ezt az elektródok polaritásának megváltoztatásával érhetjük el. A tápegység további jellemzője, hogy egyaránt alkalmas feszültség, áramerősség vagy teljesítmény gradiens megvalósítására.
A két leggyakrabban használatos CE mintabeviteli módszer a hidrodinamikai és az elektrokinetikus adagolás. Hidrodinamikus mintabevitel esetén a kapilláris injektálási végénél nyomást, vagy a másik végénél vákuumot alkalmazunk. Az adagolás során alkalmazott nyomás és idő paraméterek általában 25-100 mbar, illetve 0,5-5 s között változnak. A mintatartóban lévő gázok összenyomhatósága miatt nem lehet pillanatszerűen nyomást létrehozni, illetve megszűntetni. A reprodukálható térfogatok beadagolása a nyomás fokozatos (időben szabályosan változó) növelésével, illetve ugyanilyen módon kivitelezett csökkentésével, valamint a megfelelő adagolási idő megadásával érhető el.
Az elektrokinetikus (elektromigrációs) adagolás esetén a kapilláris bemeneti végét a mintatartó edénybe helyezzük, és feszültséget kapcsolunk rá. Az elektrokinetikus mintabevitel során a mintát alkotó komponensek a részecskék elektroforetikus vándorlása illetve az EOF szívó hatása révén jutnak be a kapillárisba. A kapillárisba juttatott mintamennyiség függ a részecskék elektroforetikus mozgékonyságától. Az elektrokinetikus adagolás hátránya, hogy kevésbé reprodukálható, mert a vezetőképességben bekövetkező változások feszültségesést okozhatnak, így különböző adagolt mennyiségeket eredményeznek. Előnye a hidrodinamikai injektálással szemben, hogy nagyon egyszerű, kisebb műszerezettséget igényel, illetve viszkózus minták vagy akár gélek elemzésénél is alkalmazható. Az említett minatadagolási lehetőségeket az alábbi ábrán mutatjuk be.
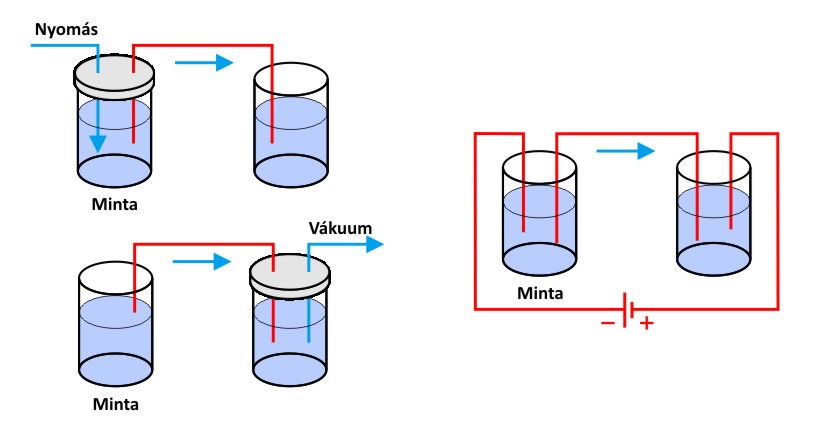
A kapilláris elektroforézis hidrodinamikai (balra) és elektrokinetikus (jobbra) mintabeviteli módszerei
A kapilláris elektroforézis alkalmazási területe elvileg jóval szélesebb körű a klasszikus elektroforézisnél, köszönhetően az elválasztás nagy hatékonyságának és a HPLC-hez hasonló műszerezettségének. Eleinte csak biológiai makromolekulák vizsgálatára használták, ma már azonban –a HPLC-hez hasonlóan– alkalmas aminosavak, királis vegyületek, vitaminok, fehérjék, gyógyszerhatóanyagok, szerves és szervetlen ionok minőségi és mennyiségi meghatározására egyaránt. A CE bizonyos jellemzőit tekintve jóval előnyösebb a HPLC-nél (pl. élesebb csúcsok, nagyobb hatékonyság, rövidebb analízisidő). Alkalmazása azonban mégis kevésbé nyert teret a folyadékkromatográfiás módszerekhez képest, aminek oka lehet a HPLC mögött álló jóval nagyobb tapasztalat, a reprodukálhatóbb analízisek, illetve a CE detektor nagyobb kimutatási határa. A CE mellett további előnyként említhető, hogy a technika az alkalmazott minimális oldatmennyiségekkel egyszerűbb módszerfejlesztést, és gyakorlatilag szerves oldószerektől mentes munkát tesz lehetővé.
Mit nevezünk elektroforézisnek?
Hogyan jön létre az elektroozmotikus áramlás?
Hogyan jön létre az elválasztás a kapilláris elektroforézis során?
Anódos injektálás esetén milyen irányba és mekkora vándorlási sebességgel mozognak a kationok?
Milyen detektorokat lehet alkalmazni a kapilláris elektroforetikus készülékben?
Milyen fontos elvárásoknak kell megfelelni a kapilláris elektroforézisnél alkalmazott detektoroknak?
Milyen mintabeviteli lehetőségek vannak a kapilláris elektroforézisnél?
Hogyan lehet növelni a fényút hosszát a kapillárisban?
Milyen előnyei vannak a kapilláris elektroforézisnek?